
Wärmelehre Allgemein
Die Wärmelehre oder Thermodynamik ist ein Teilgebiet der Physik und befasst sich mit der Temperatur von Körpern. In der Wärmelehre wird die Welt in sogenannte thermodynamische Systeme unterteilt. Ein thermodynamisches System ist ein räumlich abgegrenzter Bereich, wie zum Beispiel ein Wasserglas. Dabei lernst du die wichtigen Eigenschaften eines Systems kennen. Außerdem beschäftigt sich die Wärmelehre mit der Übertragung von Wärme zwischen mehreren Systemen.
Zustandsgrößen eines Systems
In der Wärmelehre kannst du ein thermodynamisches Systems durch seine Zustandsgrößen beschrieben. Die wichtigsten Größen sind:
- Druck
- Temperatur
- Volumen
Aus den Zustandsgrößen setzt sich die thermische Energie zusammen, welche wiederum Teil der inneren Energie ist. Die innere Energie ist die gesamte Energie eines Systems. Merke: Die Temperatur bezeichnet die mittlere Bewegungsenergie der Teilchen. Steigt die Temperatur, so werden die Teilchen also schneller. Mit der Temperatur steigt auch die thermische Energie und somit die innere Energie. Je nachdem, ob ein System Materie- und/oder Energie mit einem anderen System austauscht, unterscheidest du drei verschiedene Arten:
| Art | Materieaustausch | Energieaustausch | Beispiel |
|---|---|---|---|
| Offen | Ja | Ja | Kochtopf |
| Geschlossen | Nein | Ja | Fahrradschlauch |
| Isoliert | Nein | Nein | perfekt isolierter Behälter |
Zustandsänderung eines Systems
Die Wärmelehre behandelt auch die Änderung eines Systems. Genauer gesagt, die Änderungen der Zustandsgrößen. Dabei unterscheidest du zwischen verschiedenen Arten der Zustandsänderung. Du kannst sie durch die Zustandsgröße unterscheiden, die bei der Änderung konstant bleibt, während sich die anderen beiden ändern.
| Isobar | Isochore | Isotherm |
|---|---|---|
| konstanter Druck | konstantes Volumen | konstante Temperatur |
4 Hauptsätze der Thermodynamik
Das Verhalten zwischen mehreren Systemen kannst du mit den 4 Hauptsätzen der Thermodynamik beschreiben. Das sind vier grundlegende Regeln der Wärmelehre. Stell dir zur Veranschaulichung der Hauptsätze vor, dass du Eiswürfel in ein Wasserglas fallen lässt. Jetzt gibt es das Wasserglas-System und das Eiswürfel-System, die in einem Energieaustausch stehen.
- 0. Hauptsatz:
Zwei Systeme im Energieaustausch streben die gleiche thermische Energie an. Wasser und Eis haben unterschiedliche Temperaturen und damit unterschiedliche thermische Energien. Diese muss also übertragen werden. - 1. Hauptsatz:
Die thermische Energie kann in Form von Wärme und Arbeit übertragen werden. Dabei sind Wärme und Arbeit nur Überträger der Energie. Da die Übertragung kein Zustand, sondern ein Prozess ist, nennst du sie Prozessgrößen.Die Änderung der inneren Energie (∆U) eines geschlossenen Systems ist gleich der Summe der Änderung der Wärme (∆Q) und der Änderung der Arbeit (∆W).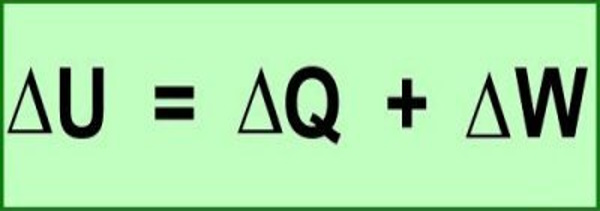 Abbildung: 1
Abbildung: 1
- 2. Hauptsatz:
Die Richtung der Energie verläuft immer vom wärmeren zum kälteren Körper. Im Beispiel hat das Wasser die höhere thermische Energie und überträgt daher seine Energie durch Wärme auf das Eis. - 3. Hauptsatz:
Kein Stoff kann auf den absoluten Nullwert -273.15°C oder 0°K abgekühlt werden. Seine Entropie (Maß der Unordnung) kann somit nicht gegen Null gehen.
Merke: Temperatur beschreibt den Zustand eines Systems. Wärme dagegen ist ein Überträger von Energie und entsteht, wenn sich zwei Systeme mit unterschiedlicher Temperatur einander angleichen.
Übertragung von Wärme zwischen Stoffen
Die Wärmelehre behandelt zudem die Wärmeübertragung zwischen zwei Stoffen. Dabei sind zwei Stoffeigenschaften relevant:
- die Wärmeleitfähigkeitbemisst den Wärmetransport innerhalb eines Stoffes
- die Wärmekapazität gibt die Wärmemenge pro Temperatureinheit an
 Abbildung: 2
Abbildung: 2
-
Wärmeleitung
- Bei jedem Material & Aggregatzustand.
- Heiße Teilchen bewegen sich schneller, stoßen auf Nachbarteilchen & übertragen Energie auf diese.
- Wärme wird von Bereichen höherer Temperatur zu Bereichen mit niedrigerer Temperatur übertragen.
- Wärmefähigkeit: Gibt an, wie gut ein Stoff Wärme leitet
- Isolatoren: Stoffe, die die Wärme schlecht leiten (Styropor, Gase, Flüssigkeiten)
- Alltagsbeispiele: Metalle, Kochtopf mit Wasser
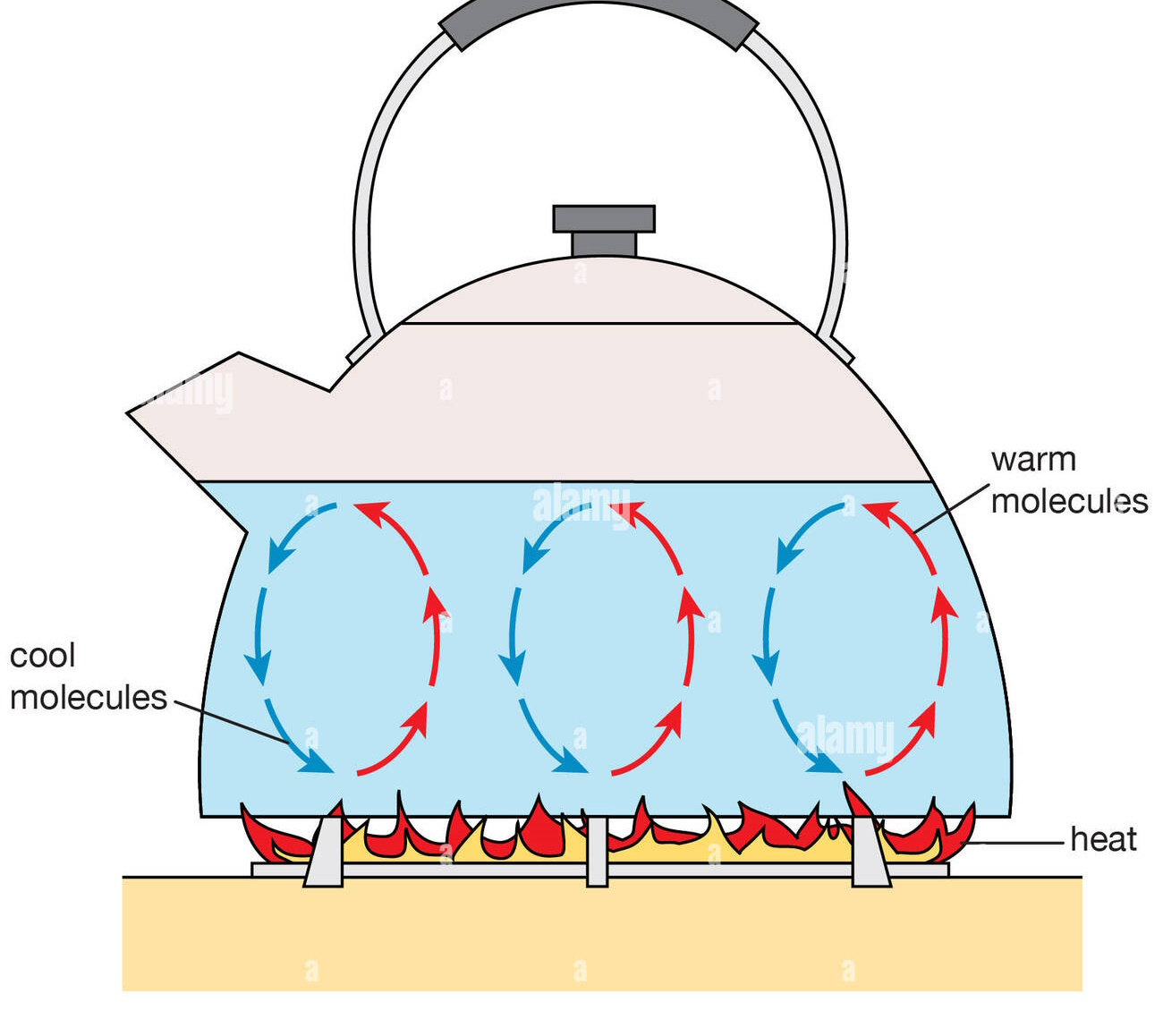 Abbildung: 3
Abbildung: 3
-
Wärmekonvektion
Bei Gasen:- Luft wird von Kerze erwärmt, steigt auf, wegen geringerer Dichte
- Luft kühlt wieder ab, sinkt ab, strömt seitlich wieder nach
- Luft wird wieder erwärmt, steigt auf
- Es bildet einen Sog
- Aufsteigende Luft gibt Wärme an Umgebungsluft ab
Bei Flüssigkeiten
- Wasser wird durch Flamme erhitzt, steigt nach oben
- Wasser kühlt oben ab und sinkt nach unten
- Bildet kreisförmige Strömung
- Wärme wird dadurch an kühleres Wasser abgegeben
 Abbildung: 4
Abbildung: 4
-
Wärmestrahlung
- Wärmeenergie durch Strahlung transportiert
- Kein Material nötig
| Wärmeübertragung | | |
|---|---|---|
| Übertragungsart | Übertragung | Koeffizient |
| Wärmeleitung | innerhalb von Festkörpern | Wärmedurchlassungskoeffizient |
| Wärmekonvektion | innerhalb von Gasen/Fluiden | Wärmeübergangskoeffizient |
| Wärmestrahlung | über elektromagnetische Wellen | Wärmeübergangskoeffizient |
Wärmelehre — häufigste Fragen
-
Was ist Wärmelehre?
Die Wärmelehre ist ein Teilgebiet der Physik, welche sich mit der thermischen Energie in und zwischen Körpern beschäftigt. -
Was ist ein thermisches Gleichgewicht?
Ein thermisches Gleichgewicht herrscht zwischen mehreren Systemen, in dem alle beteiligten Systeme dieselbe Temperatur haben. -
Was ist der Unterschied zwischen Wärme und Temperatur?
Temperatur ist eine Zustandsgröße und sagt etwas über die mittlere kinetische Energie der Teilchen aus. Wärme ist eine Prozessgröße und sagt etwas über die Übertragung von innerer Energie aus.